Hoofdstuk 3: Reacties
Samenvatting
Reacties herkennen (3.1 en 3.2 )
Een chemische reactie is een gebeurtenis waarbij stoffen verdwijnen en nieuwe stoffen ontstaan. Bij een reactie verdwijnen de beginstoffen. Er ontstaan nieuwe stoffen: de reactieproducten.

Bij de verbranding van magnesium verdwijnen magnesium en een deel van de zuurstof in de lucht. Uit het magnesium en de zuurstof ontstaat magnesiumoxide.
Magnesium en zuurstof zijn de beginstoffen. Magnesiumoxide is het reactieproduct.
Andere voorbeelden van reacties zijn: het ontploffen van kruit, asprobruis in water, het gisten van druivensap en de bereiding van ijzer.
Het verbranden van
magnesium is een voorbeeld van een reactie.
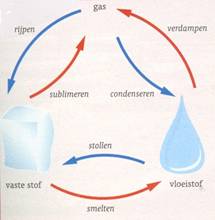
Bij faseveranderingen ontstaan géén nieuwe stoffen. Als een vaste stof smelt, dan wordt de vaste stof een vloeistof. Door de vloeistof af te koelen, krijg je dezelfde vaste stof terug (alleen de vorm kan anders zijn).
 Bijvoorbeeld het smelten van tin tot vloeibaar tin. Vast tin bestaat
uit tin. Vloeibaar tin bestaat ook uit tin. Als je de vloeibare tin in een
mal giet, dan gaat de tin door afkoeling stollen. De gestolde tin heeft dan
de vorm van de mal aangenomen. Maar het vaste tin bestaat nog steeds uit hetzelfde
tin van voor het smelten en stollen. De stof tin is niet veranderd!
Bijvoorbeeld het smelten van tin tot vloeibaar tin. Vast tin bestaat
uit tin. Vloeibaar tin bestaat ook uit tin. Als je de vloeibare tin in een
mal giet, dan gaat de tin door afkoeling stollen. De gestolde tin heeft dan
de vorm van de mal aangenomen. Maar het vaste tin bestaat nog steeds uit hetzelfde
tin van voor het smelten en stollen. De stof tin is niet veranderd!
Het smelten van tin is géén reactie.
Bij oplossen, destilleren en indampen ontstaan ook geen nieuwe stoffen. Hier is dus geen sprake van een reactie. Bij oplossen meng je een vaste stof met een vloeistof. Je krijgt dan een oplossing. Deze oplossing kun je indampen. De vloeistof verdampt en de vaste stof blijft achter. De vloeistof is het oplosmiddel. De vaste stof is de opgeloste stof.
Bij destilleren ga je een mengsel van vloeistoffen met verschillende kookpunten van elkaar scheiden. De vloeistoffen uit het mengsel veranderen niet.
Chemische reacties herken je aan reactieverschijnselen. Je herkent een reactie ook door te letten op de stofeigenschappen. De stofeigenschappen veranderen. Magnesiumoxide heeft andere eigenschappen dan magnesium en zuurstof.
Reactieverschijnselen (3.1)
Bij een reactie kunnen de volgende verschijnselen
voorkomen:
· warmte, bij een verbranding
· geluid, bij een explosie
· geur, bij een gasontwikkeling
· kleurverandering, bij het samenvoegen van twee zouten
· het ontstaan van gassen, bij een verbranding.
Reacties uit het dagelijks leven (3.3)
· De vertering van voedsel in ons lichaam
· Voedselbereiding: koken, bakken en braden
· Het bederven van voedsel door rotten of gisten
· Haarverven en permanenten
· Verkleuren van kleding door inwerking van zonlicht of een bleekmiddel
· De werking van bestrijdingsmiddelen
· Het hard worden van beton
Ontledingsreacties: thermolyse en elektrolyse (3.4)
Bij een ontledingsreactie heb je één beginstof en meer reactieproducten.
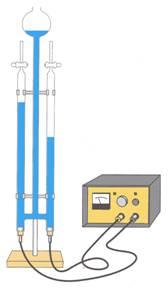 Bij een thermolyse ontleedt de stof door warmte. De thermolyse
van suiker bijvoorbeeld. Bij de ontleding van de beginstof suiker ontstaan de
reactieproducten suikerkool, water en brandbare gassen.
Bij een thermolyse ontleedt de stof door warmte. De thermolyse
van suiker bijvoorbeeld. Bij de ontleding van de beginstof suiker ontstaan de
reactieproducten suikerkool, water en brandbare gassen.
Bij elektrolyse ontleedt de
stof door elektrische stroom. De elektrolyse van water bijvoorbeeld.
Bij de ontleding van de beginstof
water ontstaan de reactieproducten waterstof en zuurstof in de verhouding 2 :
1. Er ontstaat twee keer zoveel waterstof als zuurstof.
Bij de elektrolyse van water ontleedt water in de gassen waterstof en zuurstof. Waterstof kun je niet ontleden. Waterstof heet een niet-ontleedbare stof. Zuurstof kun je ook niet ontleden. Zuurstof is ook een niet-ontleedbare stof.
En water is een ontleedbare stof. Want je kunt water ontleden.
Elektrolyse van water.
Glucose, kalk, waterstof en zuurstof aantonen (3.4)
Glucose toon
je aan met een teststrookje voor glucose. Het teststrookje verandert van kleur.
Kalk toon je aan met zoutzuur. Er ontstaat een gas en het kalk verdwijnt.
Waterstof toon je aan door het gas op te vangen in een reageerbuis. Het gas steek je aan. Je hoort een knal.
Zuurstof toon je aan met een gloeiende houtje. In zuurstof gaat een gloeiende houtje fel branden.
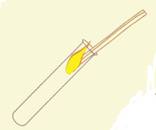

Zuurstof en waterstof
aantonen
3.5 Namen en symbolen van niet ontleedbare stoffen opzoeken
Bij de elektrolyse van water ontstaan de gassen
waterstof en zuurstof. Waterstof en zuurstof zijn beide niet ontleedbare stoffen.
Er zijn 92 niet-ontleedbare stoffen. De meeste staan in de Binas kgt, tabel 30. Elke niet-ontleedbare stof heeft een symbool. Het symbool van waterstof = H, het symbool van zuurstof = O. Je moet in elk geval de namen van de volgende scheikundige symbolen kennen. Je moet ook bij de namen de scheikundige symbolen weten.
|
symbool |
naam |
symbool |
naam |
symbool |
naam |
symbool |
naam |
|
Ag |
zilver |
Cd |
cadmium |
Hg |
kwik |
O |
zuurstof |
|
Al |
aluminium |
Cl |
chloor |
I |
jood |
P |
fosfor |
|
Ar |
argon |
Cr |
chroom |
K |
kalium |
Pb |
lood |
|
Au |
goud |
Cu |
koper |
Mg |
magnesium |
Pt |
platina |
|
Ba |
barium |
F |
fluor |
N |
stikstof |
S |
zwavel |
|
Br |
broom |
Fe |
ijzer |
Na |
natrium |
Si |
silicium |
|
C |
koolstof |
H |
waterstof |
Ne |
neon |
Sn |
tin |
|
Ca |
calcium |
He |
helium |
Ni |
nikkel |
Zn |
zink |
3.5 Een kommaformule opstellen
Ontleedbare stoffen kun je aangeven met een kommaformule.
De symbolen geven de niet-ontleedbare stoffen aan die je door ontleding uit
de stof kunt maken.
Je kunt uit water door elektrolyse waterstof (H) en zuurstof (O) maken. De
kommaformule van water is dus H,O.
Een ontleedbare stof heet ook wel verbinding.
Aan de formule van een ontleedbare stof kun je zien welke niet-ontleedbare stoffen je van de stof kunt maken. IJzeroxide heeft de kommaformule Fe,O. Uit ijzeroxide kun je ijzer (Fe) en zuurstof (O) maken.
3.5 Een reactieschema opstellen
aardgas + zuurstof --> water + koolstofdioxide
Voor de pijl staan de beginstoffen. --> Na de pijl staan de reactieproducten.
Het reactieschema voor de ontleding van water is:
water --> waterstof + zuurstof.
Een reactieschema kun je ook in symbolen noteren. Bijvoorbeeld het reactieschema voor de verbranding van aardgas.
|
Dat doe je met de volgende vijf stappen: |
Voorbeeld: De verbranding van
aardgas |
||
|
1 |
Wat zijn de beginstoffen en
wat de reactieproducten? |
1 |
beginstoffen: aardgas en zuurstof reactieproducten: water en koolstofdioxide |
|
2 |
Schrijf het reactieschema
in woorden op |
2 |
Reactieschema: aardgas + zuurstof --> water + koolstofdioxide |
|
3 |
Zoek van elke stof het
symbool of de kommaformule. |
3 |
aardgas = C,H zuurstof = O water = H,O koolstofdioxide = C,O |
|
4 |
Geef het reactieschema in
symbolen |
4 |
C,H + O --> H,O + C,O |
|
5 |
Controleer of elk symbool
vóór de pijl ook na de pijl voorkomt. |
5 |
Voor de pijl staan de symbolen: C, H en O. Achter de pijl staan de symbolen: C, H en O. |
Vragen
antwoorden op deze vragen staan hieronder
De schematische tekening stelt het proces voor,
waarbij uit een mengsel van stikstof en waterstof ammoniak ontstaat.
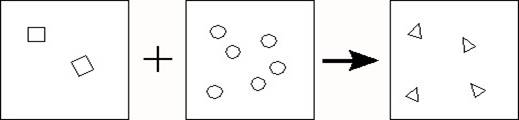
1 Bekijk de volgende beweringen:
1
De
tekening stelt een chemische reactie voor.
2
Ammoniak
heeft dezelfde eigenschappen als een mengsel van stikstof en waterstof.
Welke van deze beweringen is juist?
A
geen van
beide
B
alleen 1
C
alleen 2
D
zowel 1
als 2
2 Welke stof is bij deze reactie het reactieproduct?
3 Bij een reactie ontstaat een gas. Je vangt dat gas
op in een reageerbuis.
a Wat moet je doen om te onderzoeken of het gas
waterstof is?
b Wat moet je doen om te onderzoeken of het gas
zuurstof is?
4 Je verwarmt een oranjekleurige stof in een
reageerbuis. Jouw partner houdt tijdens het verwarmen regelmatig een gloeiende
houtspaander in de opening van de buis. De houtspaander begint dan steeds te
branden. Na afloop zit een zilverkleurige stof aan de binnenkant van de buis.
Welke van de volgende beweringen over deze proef is juist?
1
De oranje
stof wordt ontleed.
2
Tijdens
het verwarmen ontstaat zuurstof.
A geen van beide
B
alleen 1
C alleen 2
D
zowel 1
als 2
5 Ab verwarmt in een reageerbuis een kleurloze
vloeistof. Daarna laat hij de buis met inhoud afkoelen. Het ziet hierbij de
volgende verschijnselen.
1
De
vloeistof wordt bij verwarming geel.
2
De
ontstane gele vloeistof stolt bij afkoeling.
Bij welk van deze verschijnselen is sprake van een
chemische reactie?
6 Bekijk het volgende schema.
ijzer + zwavel --> ijzersulfide
Wat stelt dit schema voor?
7 Kaliumchloraat ontleedt bij verhitting in
kaliumchloride (K,Cl) en zuurstof.
a Maak het reactieschema van deze ontleding in
woorden.
b Maak het reactieschema van deze ontleding in
symbolen.
Antwoorden
1 Uit twee verschillende stoffen ontstaat één andere
stof. Dat geeft aan dat er een reactie is geweest. Bewering 1 is
correct.
Ammoniak heeft een andere geur dan stikstof en waterstof. Ammoniak lost goed op
in water; stikstof en waterstof lossen minder goed op in water. Bewering 2
is ook goed.
Antwoord D is juist.
2 Het reactieproduct is de stof die ontstaat. Hier
dus ammoniak.
3 a
Waterstof toon je aan door het gas op te vangen in een reageerbuis. Het gas
steek je aan.
Je hoort een knal.
b Zuurstof toon je aan met een gloeiende
houtje. In zuurstof gaat een gloeiende houtje fel branden.
4 De oranje stof is verdwenen. Er zijn twee andere
stoffen ontstaan. De oranje stof is dus ontleed.
De gloeiende houtspaander begint steeds te branden. Dat kan alleen in de
aanwezigheid van zuurstof.
Beide beweringen zijn daarom juist: antwoord D.
5 Bij verschijnsel 1 zie je een
kleurverandering. Deze gele kleur blijft. De kleurverandering geeft aan dat er
een reactie was.
Bij verschijnsel 2 verandert alleen de fase van een stof.
Faseverandering is geen kenmerk van een reactie.
6 Het schema hoort bij de reactie tussen ijzer en
zwavel.
7 a
1 De
beginstof is kaliumchloraat. De reactieproducten zijn kaliumchloride en
zuurstof.
2 Reactieschema: kaliumchloraat --> kaliumchloride + zuurstof
b 3 kaliumchloride = K,Cl
zuurstof = O
Uit kaliumchloraat ontstaat--> kaliumchloride + zuurstof, dus
Kaliumchloraat = K,Cl,O
4 K,Cl,O -->K,Cl + O
5 Voor de pijl staan de symbolen
K, Cl en O.
Achter de pijl staan de symbolen K,
Cl en O.