Bij gele vlammen ontstaat roet (4.1)
Vlammen kunnen geel of blauw zijn.
Bij een verbranding met gele vlammen ontstaat roet.
Bij een verbranding met een blauwe vlam ontstaat geen roet.
Een vlam is een gloeiend gas.
Vonken bestaan uit gloeiende vaste deeltjes.
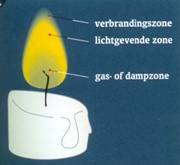
De voorwaarden voor een verbranding (4.2)
Voor een verbranding zijn nodig:
·
een brandbare stof,
·
zuurstof,
·
een ontbrandingstemperatuur.
De ontbrandingstemperatuur is de temperatuur waarbij een brandstof gaat
branden. De ontbrandingstemperatuur is voor elke stof anders.
Hoe blusmiddelen werken en het juiste blusmiddel kiezen (4.2)
 Een brand blus je door een
of meer brandvoorwaarden weg te halen.
Een brand blus je door een
of meer brandvoorwaarden weg te halen.
Met zand, schuim, koolstofdioxide en een blusdeken sluit je de brandende
stof af van zuurstof.
Met water en zand verlaag je de temperatuur van de brand. Als je blust met
water, dan ontstaat ook waterdamp. De waterdamp verhindert dat veel zuurstof
bij de brand komt.
Benzinebranden en oliebranden blus je niet met water. Benzinebranden en oliebranden
blus je met schuim, koolstofdioxide of met een blusdeken.
Bij een gasbrand draai je gaskraan dicht.
Bij de meeste andere branden zijn water en zand geschikte blusmiddelen.
Verbrandingsproducten (4.3)
Bij een verbranding reageert de brandstof met zuurstof. Als reactieproducten
ontstaan oxiden.
Bij de verbranding van koolstof ontstaat koolstofdioxide. Koolstofdioxide
is een voorbeeld van een oxide. Een oxide is een ontleedbare stof. In de kommaformule
van een oxide komen voor: het symbool van zuurstof en één andere symbool.
C,O en H,O zijn oxiden. H,S,O is geen oxide.
Reactieschema's van verbrandingen (4.3)
Voor het opstellen van een reactieschema van een verbranding gebruik je
de volgende stappen:
1
Wat zijn de beginstoffen en wat de reactieproducten.
2
Schrijf het reactieschema in woorden op.
Links zet je de beginstoffen met een + ertussen, dan een -->. Rechts zet je de reactieproducten, ook met
een + ertussen.
3
Bedenk van elke stof het symbool of de
kommaformule of zoek het symbool of de kommaformule op.
4
Geef het reactieschema in symbolen. Dit doe je door de woorden te vervangen
door formules.
5
Zet daarna achter elke stof de toestand waarin de stof voorkomt.
6
Controleer of links en rechts van de pijl dezelfde symbolen voorkomen.
Neem bijvoorbeeld de verbranding van benzine.
1
beginstoffen: benzine en zuurstof
reactieproducten: koolstofdioxide en water
2
het reactieschema in woorden:
benzine + zuurstof --> koolstofdioxide + water
3
benzine = C,H
zuurstof = O
koolstofdioxide = C,O
water = H,O
4
het reactieschema in symbolen:
C,H + O --> C,O + H,O
5
het reactieschema met toestandsaanduidingen:
C,H(l) + O(g) --> C,O(g) + H,O(l)
6
links: C, H en O
rechts: C, H en O. Dezelfde symbolen dus.
Toestandsaanduidingen (4.3)
Stoffen kunnen in vier toestanden voorkomen:
·
vast (s)
·
vloeibaar (l)
·
gasvormig (g)
·
opgelost in water (aq)
Onvolledige verbranding levert gevaar op (4.3)
In verbrandingsapparaten moet je zorgen voor voldoende luchttoevoer. Anders
ontstaat het giftige koolstofmonooxide. De kommaformule van koolstofmonooxide
= C,O.
Verbrandingsproducten onderzoeken (4.4)
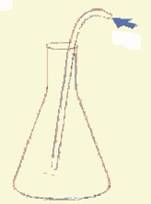
Door koolstofdioxide wordt helder kalkwater troebel.
Het verbrandingsproduct water toon je aan met het reagens wit kopersulfaat.
Met water wordt wit kopersulfaat blauw.
Het verbrandingsproduct koolstofdioxide toon je aan met het reagens kalkwater.
Kalkwater wordt met koolstofdioxide troebel.
Als je bij een verbranding water en koolstofdioxide hebt aangetoond, dan
betekent dit dat de verbrande stof de kommaformule C,H heeft.
Gevolgen van verbrandingen voor gezondheid en milieu (4.5)
Zwaveldioxide en stikstofoxiden veroorzaken luchtverontreiniging.
Zwaveldioxide en stikstofoxiden tasten de luchtwegen aan en veroorzaken
'zure regen'.
De toenemende uitstoot van koolstofdioxide versterkt mogelijk het broeikaseffect
waardoor de aarde warmer wordt.
Maatregelen om de schadelijke gevolgen van verbrandingen te voorkomen (4.5)
Steenkool bevat veel zwavel. Bij de verbranding van steenkool ontstaat zwaveldioxide.
De uitstoot van zwaveldioxide wordt tegengegaan door de verbrandingsgassen
te ontzwavel met calciumoxide. Daarbij ontstaat gips.
Je kunt ook sommige zwavelhoudende brandstoffen ontzwavelen. Je brengt dan
de zwavelhoudende brandstof in contact met stoffen waaraan de zwavel gaat
vastzitten.
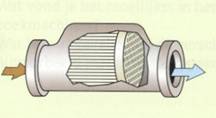
De verbranding van benzine in auto’s is nooit volledig. Er ontstaan altijd
koolstofmonooxide en stikstofoxiden. Bovendien komen onverbrande koolwaterstoffen
vrij. Een
katalysator zorgt ervoor dat koolstofmonooxide, stikstofoxiden en onverbrande
koolwaterstoffen met de nog niet verbruikte zuurstof worden omgezet in koolstofdioxide,
water en stikstof.
De autokatalysator beperkt zo de uitstoot van stikstofoxiden, koolstofmonooxide
en onverbrande koolwaterstoffen.
De effecten van cfk’s op het milieu (4.5)
Cfk’s (chloorfluorkoolwaterstoffen) worden gebruikt in koelkasten en spuitbussen.
Wanneer Cfk’s in de lucht komen, dan wordt de ozonlaag aangetast. Hierdoor
komt meer schadelijke UV-straling op de aarde. Dit is schadelijk voor de gezondheid.
In plaats van Cfk’s gebruiken we in koelkasten andere stoffen, zoals ammoniak.
Vragen
antwoorden op deze vragen staan hieronder
1
René doet twee proeven:
1
Hij brengt alcohol aan de kook. De alcohol
gaat niet branden.
2
Hij houdt een brandende lucifer bij de
alcohol. De alcohol gaat branden
Het kookpunt van alcohol is 78ºC. De vlamtemperatuur
van een brandende lucifer is 400ºC.
Wat kun je uit deze proeven concluderen over de ontbrandingstemperatuur
van alcohol?
2
Bekijk de volgende beweringen:
1
Tijdens de verbranding van een stof komt
warmte vrij.
2
Voor iedere verbranding is brandstof nodig.
Welke van deze beweringen is juist?
3
Alice laat een brandende kaars in een hoog glas met
zuurstof zakken.
a
Wat gebeurt dan onmiddellijk met de kaars?
b
Gaat het gas in het glas dan ontbranden?
4
Je zet een bekerglas omgekeerd over een brandend
kaarsje. Na enige tijd gaat het kaarsje vanzelf uit.
Welke drie gassen bevinden zich hoofdzakelijk onder het bekerglas?
5
Je wilt een benzinebrand blussen met water? Dat gaat
niet zo best. Waardoor komt dat?
6
Nadja onderzoekt uitgeademde lucht. Ze blaast enige
tijd
1
over blauw kopersulfaat
2
door helder kalkwater
In welk van deze gevallen treedt een chemische reactie
op?
7
Bekijk de volgende reactieschema’s:
1
Mg(s) + O(g) --> MgO(s)
2
Ca,C,O(s) --> Ca,O(s) + C,O(g)
3
H,O(l) --> H(g) + O(g)
4
H,O(l) --> H,O(g) + O(g)
5
H(g) + O(g) --> H,O(l)
a
Welke reactieschema’s zijn van verbrandingen?
b
Welke reactieschema’s zijn van een ontleding?
8
Bij de volledige verbranding van aardgas ontstaan
stikstofoxiden.
a
Geef de namen van de andere reactieproducten die
bij de volledige verbranding van aardgas ontstaan.
b
Wat kan door stikstofoxiden ontstaan?
9

In
de figuur is een van de reacties die in een autokatalysator optreedt schematisch
weergegeven.